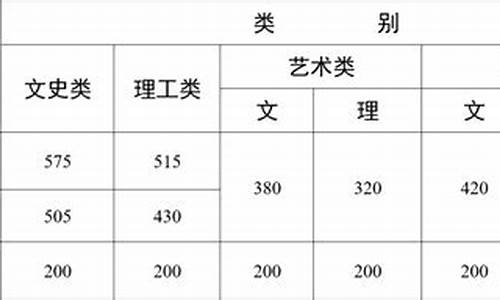
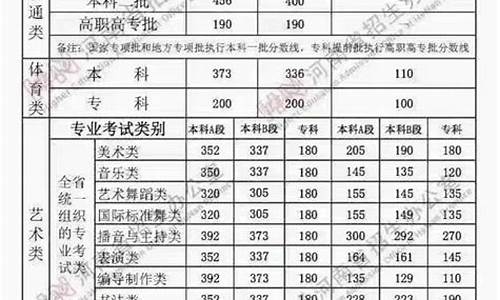
您现在的位置是: 首页 > 政策解读 政策解读
化学高考题及解析,高考化学例题及解析
tamoadmin 2024-05-26 人已围观
简介1.两道高考的化学题求解~~2.高考化学题目,关于有机物燃烧的化学反应方程式进行体积分数的计算。3.陕西教育考试院:2021年陕西高考化学试题评析4.高一化学 6道推断的高考题 积分想要多少(只要我有)就给多少1、2NH3+3NO=催化剂=3N2+H2O解释:NO的N是+2价NH3的N是-3价,N2的N是0价,+2x3-3x2=0氧化还原反应配平得失电子总数相等2、氧化产物是还原剂变过来的产物(还
1.两道高考的化学题求解~~
2.高考化学题目,关于有机物燃烧的化学反应方程式进行体积分数的计算。
3.陕西教育考试院:2021年陕西高考化学试题评析
4.高一化学 6道推断的高考题 积分想要多少(只要我有)就给多少

1、2NH3+3NO=催化剂=3N2+H2O解释:NO的N是+2价NH3的N是-3价,N2的N是0价,+2x3-3x2=0氧化还原反应配平得失电子总数相等
2、氧化产物是还原剂变过来的产物(还原剂被氧化,发生氧化反应得到氧化后的产物简称氧化产物)
还原产物是氧化剂变过来的产物(氧化剂被还原,发生还原反应得到还原后的产物简称还原产物)
因为在这个反应氧化剂是NH3,而还原剂是NO,里面氧化产物和还原产物都是N2,2.8/28g/mol=0.1molN2,即0.2molN,而反应中2molNH3和3molNO氧化产物比还原产物多1mol的N,所以参与氧化还原反应的实际只有NO=0.6mol,NH3=0.4mol,因为他们两之和为2mol。
总共有两种情况1、NH3=1.4mol,NO=0.6mol,2、NH3=0.4mol,NO=1.6mol
两道高考的化学题求解~~
例1、 下列变化,必须加入还原剂才能实现的是:
A、NH4+——NH3 B、C——CO2 C、SO2——S D、Cl2——Cl-
误答原因:(1)误答A选项。原因是不会判断元素的化合价。
(2)误答B选项。原因是思维混乱(或将关系记反了)。
(3)误答D选项。没有考虑到Cl2+H2O=HCl+HClO反应中,Cl2既是氧化剂又是还原剂。
正确分析:A选项中各元素化合价未变化,不是氧化还原反应。
B选项中碳元素从零价升高到正二价,被氧化了,需加入氧化剂。
C选项中硫元素从正四价降到零价,被还原了,需加入还原剂。
D选项中氯元素从零价降到负一价,被还原了,但是Cl2+H2O=HCl+HClO反应中,Cl2既是氧化剂又是还原剂,加入的水既不是氧化剂也不是还原剂。
正确选项:C
例2、 在PH=1的含有Mg2+、Fe2+、Al3+3种阳离子的溶液中,可能存在阴离子是:
(1)Cl- (2)NO3- (3)SO42- (4)S2-
A、(1)(2)(3) B、(2)(3) C、 (3)(4) D、(1)(3)
误答原因:误答A选项。原因是忽略题干信息PH=1,或者忽略酸性溶液中NO3-的氧化性
正确分析:PH=1的溶液,即强酸性溶液,溶液中含有较多的H+,所以不能存在NO3-,因为H+、Fe2+、NO3-会发生氧化还原反应。S2-和H+发生复分解反应也不能存在。
评析:离子能否大量共存,应从两方面分析:(1)同组的离子是否发生反应:复分解反应或氧化还原反应。(2)是否符合题干要求:溶液的颜色,酸碱性等。
答案:D
例3、 已知下列三个热化学方程式:
(1) C(s)+H2O(g)=CO(g)+H2O(g);△H=+131.45KJ/mol
(2) 1/2H2(g)+1/2Cl2=HCl(g); △H=-92.3KJ/mol
(3) H2(g)+1/2O2=H2O(g); △H=-241.9KJ/mol
则上述三个反应的反应热大小关系正确的是:
A.(1)>(2)>(3) B.(3)>(2)>(1) C.(3)>(1)>(2) D.(1) >(3)>(2)
误答原因:误答A选项。原因是把反应热的“+”或“-”与反应热的数值看作一个整体进行比较,而忽视反应热是指反应过程中所放出或吸收的热量这一说法。
正确分析:反应热的“+”或“-”只说明是吸热还是放热,与数值大小无关。
答案:C
例4、 设阿伏加德罗常数的符号为NA下列叙述正确的是:
A、 一个H2O分子的质量为18/NA。
B、 1molD2O所含质子数为12NA
C、 0.5mol单质铝与足量盐酸反应,转移电子数为1.5NA
D、 标准状况下,1L水所含分子数为NA/22.4.
误答原因:误答A选项。原因是粗心大意,没有留心单位。
误答B选项。错选原因是混淆质子与中子。
误答D选项。原因是对气体摩尔体积的概念领会不深或误认为水为气体。
正确分析:1molH2O的质量为18g,而1molH2O含有NA个水分子,所以1个水分子的质量应为18g/NA。
D2O与H2O的质子数是相同的,都是10,1molD2O所含质子数为10NA。
铝与盐酸反应为:2Al+6H+=2Al3++3H2↑。0.5molAl在反应中转移电子为0.5×3 NA=1.5 NA
在标准状况下,水是液态的,它的体积不符合气体摩尔体积的规定。
答案:C
举一反三:标准状况下,可能会误认为气体的物质有:Br2、SO3、六个碳原子以上的烃等等。
例5、将标准状况下336LHCl气体溶解在1L水中,得到密度为1.17g/cm3的盐酸,求此盐酸的物质的量浓度。
误答原因:错解:C=336L/22.4L.mol-1÷1L=15mol/L
错因:把溶液的体积当成1L。
正确分析:溶液的体积根据溶液的质量和密度求算。
C盐酸=336L/22.4L. mol-1÷〔(336L/22.4L. mol-1×36.5g/mol+1000ml×1g/cm3) ÷(1.17g/cm3×1000ml/L)〕=11.6mol.L-1
例6、将1%的氨水与9%的氨水等体积混合后,所得氨水的浓度__5%(填大于、小于或等于)。
误答原因:错解:氨水浓度(%)=(Vd11%+Vd29%)÷(Vd1+Vd2)×100%=(d11%+d29%)÷2
∵d1<d2 ∴大于5%。
不考虑密度的差别,或者认为浓度大的密度大,分别得出等于5%或大于5%的错误结论。
正确分析:氨水浓度越大,密度越小,等体积时,1%的氨水的质量大,而溶液质量大的所含溶质的质量少,因此,正确答案应小于5%。
设1%的密度为1%ρ1V+9%ρ2V=x%(Vρ1+Vρ2)
ρ1(1%-x%)=ρ2(x%-9%)
∵ ρ1>ρ2(氨水浓度小的密度大), 1%-x%<0,1%-x%<0
∴1%-x%>x%-9%
(1%+9%)>2x%
5%>x%即x%<5%
启示:不同浓度的同种物质的溶液等体积混合,符合以下规律:
浓度大的密度大,混合后的浓度大于两溶液浓度和的1/2;浓度的的密度小,混合后的浓度小于两溶液和的1/2。
密度不随浓度改变的,则混合后的浓度等于两溶液浓度的1/2。
注意:氨水、酒精等浓度大的密度小。
例7、8.7g的MnO2与含14.6gHCl的浓盐酸共热可生成Cl2的质量为:
A、等于14.2g
B、等于7.1g
C、7.1g----14.2g之间
D、小于7.1g
误答原因:错选A、C原因是算式列错或计算错误。
错选B。认为8.7gMnO2恰好与14.6gHCl反应,生成7.1gCl2,没有考虑到随着反应的进行,浓盐酸逐渐变为稀盐酸,稀盐酸难与MnO2反应。
正确分析:稀盐酸难跟MnO2反应,MnO2+4HCL(浓)=MnCl2+Cl2↑+2H2O随着反应的进行,浓盐酸会变为稀盐酸,使反应停止。再加上盐酸还要挥发等,14.6gHCl不可能完全反应。因而制得的Cl2小于7.1g.
举一反三:铜与浓硫酸、铜与浓硝酸的反应,随着反应的进行,酸逐渐变稀,反应也会停止或产物发生变化。
例8、(1)下列物质跟水反应时,水为还原剂的是
A.F2 B.Na C.Na2O2 D.CaO
分析:A在F2与水的反应:2F2+2H2O=4HF+O2中,氟元素从0价降到-1价,F2是氧化剂,H2O中的氧元素,从-2价升高到O2中的0价,水是还原剂。
B在Na与水的反应:2Na+2H2O=2NaOH+H2↑中,H2O中的氢元素,从+1价降低到H2中的0价,水是氧化剂。
C在Na2O2与水的反应:2Na2O2+2H2O=4NaOH+O2↑中,水既不是氧化剂也不是还原剂。
DCaO与水反应是非氧化还原反应。
答案:A
(2)将Na2O2投入FeCl2溶液中,可观察到的现象是
A、生成白色沉淀 B、生成褐色沉淀 C、有气泡产生 D、无变化
误答原因:对Na2O2、Fe(OH)2及Fe(OH)3的一些特殊性质掌握不住,从而导致错选。
正确分析:本题涉及的化学反应:
2Na2O2+2H2O=4NaOH+O2↑
FeCl2+2NaOH=Fe(OH)2↓(白色)+2NaCL
4Fe(OH)2+O2+2H2O=4Fe(OH)3↓(红褐色)
反应过程中生成的Fe(OH)2迅速变成灰绿色最终生成红褐色沉淀。
答案:B、C
(3)F2是氧化性最强的非金属单质。在加热的条件下,物质的量相等的F2(g)跟烧碱完全反应,生成NaF、H2O和某一种气体。该气体是下列中的
A、H2 B、HF C、OF2 D、O2
误答原因:本题极易受思维定势的影响错选D:2F2+4NaOH=4NaF+2H2O+O2,但是此时n(F2):n(NaOH)=2:4=1:2,不符合题意。
正确分析:根据题给条件,依据质量守恒写出该反应的化学方程式为:
2F2+2NaOH=2NaF+H2O+OF2
由此确定另一种气体为OF2
答案:C
例9、有一未知浓度的盐酸25ml,在加入0.5mol/LAgNO3溶液25ml后还有剩余盐酸,再改加NaOH溶液,结果用去1.0mol/LNaOH溶液25ml,恰好完全中和。求盐酸的物质的量浓度。
误答:HCl先与AgNO3反应,后与NaOH反应,相互反应的物质的量之比都是1:1,则HCl的物质的量等于AgNO3和NaOH物质的量之和。设盐酸的物质的量浓度为C,则
0.025C=0.5mol/L×0.025L+1.0mol/L×0.025L
C=1.5mol/L
误答原因:未考虑HCl同AgNO3反应未消耗H+
正确分析:从反应的离子方程式(1)CL-+Ag+=AgCl↓,(2)H++OH-=H2O
可以看出:
Ag NO3同HCl反应并未消耗盐酸中的H+,盐酸中的H+全部与NaOH溶液中OH-中和。所以计算盐酸的浓度根本不需考虑AgNO3的多少(在AgNO3不过量的前提下),AgNO3只是一个干扰因素。应直接根据消耗NaOH的量来计算盐酸浓度。
HCl同NaOH恰好完全中和时,n(HCl)=n(NaOH),又知V(HCl)=V(NaOH)则C(HCl)=C(NaOH)=1.0mol/l。
例10、R原子的核内质子数为m,中子数为n,则下列叙述中错误的是:
A、这种元素的相对原子质量为m+n
B、不能由此确定该元素的相对原子质量
C、其原子质量与12C原子质量之比约为(m+n):12
D、原子核内中子数为n的原子可能是R原子的同位素。
误答原因:(1)漏答(A)项或错答(B)项。原因是混淆了原子的质量数与元素相对原子质量的关系。
(2)漏答(D)。同位素的概念不清。
答案:A、D
字数受限的,其他的题目,高考比较难的,集中在推断题和实验题之类的大题,这种题目都是附的,我这边无法给你的,我建议你可以去百度文库里搜索推断题和实验题之类的,会有的。
另外,分数太少了吧。。。
望采纳。谢谢!
高考化学题目,关于有机物燃烧的化学反应方程式进行体积分数的计算。
第一题:
这道题用化学解题的常用方法:极值法。氢气的体积在标况下为11.2L,那么求出氢气的物质的量n=V/Vm=11.2/22.4=0.5mol,氢气的质量:m=n·M=0.5*2=1g,根据列方程式计算,生成1g氢气需要32.5g锌,28g铁,9g铝和12g镁,想混合后质量是10g放出1g氢气前提就是一个质量比10g小,另一个质量比10g大,只有铝的质量比10g小,所以必须有的金属是铝。
第二题:
这道题主要考察的是金属与酸反应的方程式,但是特别要注意的一点是钠不仅能与酸反应放出氢气,还能与水反应放出氢气,这是本题的关键。盐酸的物质的量为n=c*V=1*0.1=0.1mol,题中给出金属的物质的量和酸的物质的量,这时我们应该注意:镁铝与酸反应时时过量的,所以算放出氢气体积的时候应该以酸的物质的量为依据:
Mg ~ 2HCl ~ H2 2Al ~ 6HCl ~ 3H2
1 2 1 2 6 3
0.05mol 0.1 mol 0.05mol 0.1/3mol 0.1 mol 0.05mol
钠因为与水反应也能放出氢气(2Na +2H2O =2NaOH +H2),所以这时我们在计算钠放出氢气时只考虑钠的物质的量就可以了:
2Na ~ H2
0.3mol 0.15mol
所以同温同压下产生气体的体积比为0.15:0.05:0.05=3:1:1
陕西教育考试院:2021年陕西高考化学试题评析
由乙烷、乙炔和丙烯燃烧的方程式可知,除去水蒸气,恢复到原来的温度和压强,
C2H6+ 72O2=2CO2+3H2O△V?
1? 722 2.5C2H2+ 52O2=2CO2+H2O?△V
1 522 1.5C3H6+ 92O2=3CO2+3H2O?△V
1 92 3?2.5则C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质即可,
设C2H6和C3H6一共为xmL,C2H2为ymL,
则有 x+y=32
2.5x+1.5y=72,解得y=8mL,
混合烃中乙炔的体积分数为 8/32×100%=25%,
高一化学 6道推断的高考题 积分想要多少(只要我有)就给多少
注重核心价值的引领作用,落实立德树人根本任务
该套化学试题旗帜鲜明地将立德树人作为根本任务,发挥化学学科独特的育人功能,选取真实的化学科研成果,展示化学科学对人类发展和社会进步的贡献,激发学生为中华民族伟大复兴而奋斗的责任感和使命感。第11题以我国嫦娥五号探测器带回的月球土壤的成分为背景,考查元素的周期律相关知识内容。
我国提出在2030年前实现碳中和、2060年前实现碳达峰的目标,展现了我国在应对全球气候变化问题的责任与担当。化学科学在实现碳达峰和碳中和发挥重要的作用,第7题以碳中和为情境,考查如何利用化学技术减少二氧化碳。
试题选材设计废弃资源回收综合利用,第26题以磁选后的炼铁高钛炉渣为原料采用一系列工艺流程回收金属,展现化学变废为宝的神奇魅力,促进学生牢固树立绿色化学思想和环保理念。
注重对关键能力的考查,有利于科学选拔
该套高考化学注重选取新材料、新药物、新催化技术的真实情境,增强情境的时代性,进一步深化对信息获取加工、逻辑推理、归纳论证等关键能力的考查,提升对学生核心素养考查的有效性,进一步提高人才选拔质量。
一是完善信息获取与加工能力考查。信息获取与加工是整个化学学科能力发展的基础,通过表格、图像等方式提供丰富的数据信息,深入考查学生信息整理能力。例如,第13题以难溶盐的饱和溶液中阳离子浓度随氢离子的变化为素材,要求学生获取图中数据信息推导酸的电离常数、难溶电解质的沉淀溶解平衡的关系,并对信息进行深层次的加工,得到金属离子的浓度平方与氢离子浓度定量关系。
二是加强逻辑推理能力考查。通过创设复杂的问题情境,加强对学生逻辑推理能力的考查。对于真实的工业生产过程,在信息获取加工能力的基础上利用化学基础知识和基本原理,分析或选择反应条件、解读并挑选操作具体条件,推测实际工艺单元过程的操作目的。例如,第26题呈现利用炼铁高钛炉渣钛、铝、镁的工艺流程,提供有关金属离子开始沉淀和沉淀完全的pH,要求学生综合分析整个工艺流程,并根据物质转化关系选择符合要求的试剂。
三是探索归纳与论证能力考查。高考化学试题探索通过数据图的形式向学生提供信息,让学生通过化学反应原理分析数据曲线物理量之间的关系,考查学生利用数据进行归纳论证的能力。第28题巧妙地将两个反应平衡常数的对数与温度的倒数绘制成线性关系图,要求学生由图上信息获知平衡常数与温度内在关系,并在此基础上通过提供两个反应的平衡常数与温度的关系,推导出一氯化碘分解反应是吸热还是放热。
加强考教衔接,发挥考试积极导向作用
高考化学试题密切关注课程标准的学业要求和教学实际,落实《深化新时代教育评价改革总体方案》,增强试题开放性、灵活性,引导减少死记硬背和“机械刷题”现象,充分发挥高考命题的积极导向作用。
一是夯实学科基础知识,引导教学回归基础。试卷对典型化合物的性质、基本反应类型、物质基本转化规律、基本化学实验操作方法等基础知识的考查,能有效地鉴别学生的学科基础的掌握程度,有利于引导中学教学遵循教学规律、严格按照高中化学课程标准和教材进行教学、复习备考。
二是创新试题呈现方式,鼓励学生理性学习。对适合学生认知特点的化学学科基本反应原理的考查,转变呈现方式和考查思路,有利于促进学生从方法上掌握化学基础的知识内容。例如,
三是试卷总体难度适中,引导落实改革理念。今年化学试卷总体难度符合教学实际,具有一定的难度梯度,可以区分不同层次的学生,具体措施包括三个方面。第一,基础试题的数量有所增加,试卷的选择题均大幅度增加考查基本概念的试题数量,选择题包括化学生活、气体制备实验、离子方程式、有机物性质等常见的基础内容试题。第二,试题情境不再陌生。元素化合物试题是以学生熟悉的铁、钙、镁等元素的转化基础进行设计。实验试题氧化石墨烯的合成实际上是考查酸性高锰酸钾、硝'酸等氧化反应操作、基本的实验仪器名称以及常见的硫酸根和氯离子的洗涤操作方法。第三,试题计算不再复杂。对于数据计算,在设计试题时注重考查化学原理和物理量的关系。第28题一氯化碘分解反应平衡常数的计算只要求学生列出计算式即可,第35题晶胞的空间占有率也只要求学生给出表达式。
1. A:K
E:H
B:SI
C:O
D:F
(2)K2O2
2.⑴ “A和B化合生成固体C时有白烟产生”,这是一个非常明显的突破口,可确定C为NH4CI,A、B一个为NH3,一个为HCI。从而可知Y为H2,X、Z一个为CI2,一个为N2。
⑵ ②问A(气)能与NaOH反应,可推知A(气)为酸性气体,短周期非金属元素间形成的酸性气体常见的有CO2、NO2、SO2、HCI、H2S等,又“A在空气中充分燃烧可生成B”,则A为H2S,B为SO2。从而可知Y为S,X、Z一个为H2,一个为O2。③问“Y与⑴中某单质的水溶液反应可生成两种强酸”,⑴中三种单质(H2、CI2、N2)只有CI2存在水溶液,则方程式为S+3CI2+4H2O ==
H2SO4+6HCI。故本题答案为:⑴ ① H2 ;② NH3+HCI==NH4CI。 ⑵ ① SO2 ;②H2S+OH-==HS-
+H2O ;③ S+3CI2+4H2O==H2SO4+6HCI。
3.A:S2-
B:HCl
C:Cl-
D:H2S
E:F2
4.x Ca
D 氢氧化钙
Y是碳C
Z是H
XY2是碳化钙CaC2
Y2Z2是C2H2
5.1 ) 2H2S+SO2=3S+2H2O
2SO2+O2=(催化剂)=2SO3
2 ) (1)α-(BN)n和C(石墨)、β-(BN)n和C(金刚石)
(2)O3和SO2与亚硝酸根离子互为等电子体
3 ) H2SO4+Na2S=H2S(g)+Na2SO4
2NaHSO3=(加热)=Na2SO3+H2O+SO2(g)
6.还原性的不稳定的二元酸是H2SO3,所以X是SO2,Y是SO3;和热水反应生成酸要6mol一元碱中和,说明是2mol三元酸(没有符合条件的六元酸),也就是H3PO4,因此Z是P4O10(简写P2O5),A是磷。
答案:X、Y、Z是短周期元素的三种常见氧化物,X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是_H2SO3_。Y和X的组成元素相同,Y的化学式是_SO3_。1摩尔Z在加热时跟水反应的产物需要和6摩尔NAOH才能中和。在一定条件下,Y可以和非金属单质A反应生成X和Z,单质A是_磷_。