您现在的位置是: 首页 > 教育政策 教育政策
高考 化学题_高考化学例题
tamoadmin 2024-05-18 人已围观
简介1.高考化学题混合气体通过过量NaOH溶液,气体体积减少了21.28L;这是SO2+SO3的总体积,也可以说是原来的SO2体积,物质的量是0.95mol。平衡后吸收O2的体积5.6L是0.25mol。变0.452SO2+O2<=>2SO30.95----0.7-------0起始0.9------0.45-----0.9变化SO3的转化率:0.9/0.95X100%=94.7%高考化学
1.高考化学题
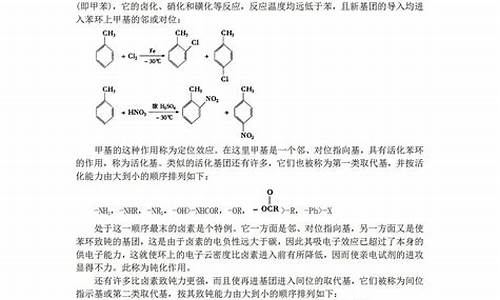
混合气体通过过量NaOH溶液,气体体积减少了21.28L;这是SO2+SO3的总体积,也可以说是原来的SO2体积,物质的量是0.95mol。平衡后吸收O2的体积5.6L是0.25mol。变0.45
2SO2+O2<=>
2SO3
0.95----0.7-------0起始
0.9------0.45-----0.9变化
SO3的转化率:0.9/0.95X100%=94.7%
高考化学题
首先感谢山东高三的学生。
解:NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是 NH4+ +H2O==(可逆)=NH3H2O+H+ (用离子方程式表示)。向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 逆向 (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为 a/200b mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
理由如下:
1.滴加氨水的过程中,将抑制水的电离。理由是加碱将抑制水的电离,故水的电离平衡将 逆向 (填“正向”“不”或“逆向”)移动。
2.由电荷守恒得:n(NH4+) +n(H+)==n(NO3-) +n(OH-),
由于溶液呈中性,所以n(H+)= +n(OH-),n(NH4+) ==n(NO3-) =a
NH3H2O==(可逆)==NH4+ +OH-
X a /b 10*-7
NH3·H2O的电离平衡常数
Kb=c( NH4+)*c( OH-)/C(NH3H2O)=[ ( a /b )*10*-7 ]/x=2×10-5mol·L-1
所以x= a/200b mol·L-1
满意望采纳,你的支持和信任是我们团队的最大光荣。祝你学习进步,天天提高。
(1)Fe3O4 + 8HCl==2FeCl3+FeCl2+4H2O
(2)KSCN
(3)2Fe2+ +Cl2=2Fe3+ +2Cl-
(4)①假设2:SCN-被过量的氯水氧化
②取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确.









