您现在的位置是: 首页 > 教育政策 教育政策
高考必修有机_高考化学有机必修部分
tamoadmin 2024-05-29 人已围观
简介1.求高中化学人教版必修二,有机化合物单元知识点总结,详细,不光是方程式,急,谢了2.高考化学(有机)3.高中化学必修二有机部分加成反应聚合反应取代反应酯化反应等反应类型对比及比较求详解?大神留步!1。乙酸和乙醇都易挥发物质,加热条件下当然会挥发出来。2。苯和水:分层,下层水,上层油状;乙酸和水:不分层;四氯化碳和水:分层,下层油状,上层水。3。这句话是对的。4。乙酸乙酯层中溶了挥发出来的乙酸,显
1.求高中化学人教版必修二,有机化合物单元知识点总结,详细,不光是方程式,急,谢了
2.高考化学(有机)
3.高中化学必修二有机部分加成反应聚合反应取代反应酯化反应等反应类型对比及比较求详解?大神留步!
1。乙酸和乙醇都易挥发物质,加热条件下当然会挥发出来。
2。苯和水:分层,下层水,上层油状;乙酸和水:不分层;四氯化碳和水:分层,下层油状,上层水。
3。这句话是对的。
4。乙酸乙酯层中溶了挥发出来的乙酸,显酸性,所以是红色。中间处,乙酸和碳酸钠酸碱中和了,所以显紫色。碳酸钠显碱性,所以显蓝色。
5。聚丙烯,已经是丙烯发生加聚反应的产物,没有C=C(碳碳双键)了,所以不发生加成或加聚反应,而聚丙烯中含有甲基所以能发生取代反应。
求高中化学人教版必修二,有机化合物单元知识点总结,详细,不光是方程式,急,谢了
由于每个人的学习基础不同,学习能力不同,所以高考化学选修选有机还是结构是因人而异的,有机化学是研究有机化合物的组成、结构、性质、制备方法与应用的科学;结构化学是研究物质分子构型与组成的相互关系以及结构和各种运动的相互影响的化学分支学科。 扩展资料 高考化学选修有机还是结构主要看个人的.学习能力以及学习兴趣,如果喜欢研究有机化合物的组成、结构、性质、制备方法,就可以选修有机化学,如果对物质分子构型与组成感兴趣,就可以选择结构化学,而有机化学又称为碳化合物的化学,有机化学可分为烷烃、烯烃、炔烃、芳香烃(以上为烃类)、卤代烃、醇、酚、醚、醛、酮、羧酸、羧酸衍生物、胺类、硝基化合物、腈类等有机化合物;而结构化学又与生物科学、地质科学、材料科学等各学科的研究相互关联、相互配合、相互促进。
高考化学(有机)
甲烷燃烧
CH4+2O2→CO2+2H2O(条件为点燃)
甲烷隔绝空气高温分解
甲烷分解很复杂,以下是最终分解。CH4→C+2H2(条件为高温高压,催化剂)
甲烷和氯气发生取代反应
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl (条件都为光照。 )
实验室制甲烷
CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)
乙烯燃烧
CH2=CH2+3O2→2CO2+2H2O(条件为点燃)
乙烯和溴水
CH2=CH2+Br2→CH2Br-CH2Br
乙烯和水
CH2=CH2+H20→CH3CH2OH (条件为催化剂)
乙烯和氯化氢
CH2=CH2+HCl→CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2→CH3-CH3 (条件为催化剂)
乙烯聚合
nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)
氯乙烯聚合
nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)
实验室制乙烯
CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)
乙炔燃烧
C2H2+3O2→2CO2+H2O (条件为点燃)
乙炔和溴水
C2H2+2Br2→C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)
实验室制乙炔
CaC2+2H2O→Ca(OH)2+C2H2↑
以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2
CaC2+2H2O→C2H2+Ca(OH)2
C+H2O===CO+H2-----高温
C2H2+H2→C2H4 ----乙炔加成生成乙烯
C2H4可聚合
苯燃烧
2C6H6+15O2→12CO2+6H2O (条件为点燃)
苯和液溴的取代
C6H6+Br2→C6H5Br+HBr
苯和浓硫酸浓硝酸
C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)
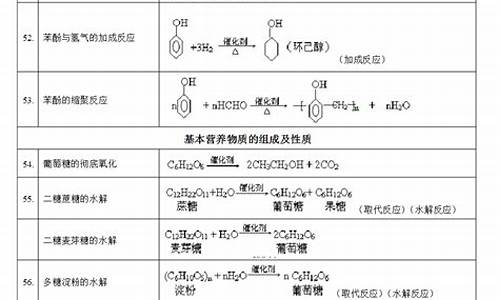
苯和氢气
C6H6+3H2→C6H12 (条件为催化剂)
乙醇完全燃烧的方程式
C2H5OH+3O2→2CO2+3H2O (条件为点燃)
乙醇的催化氧化的方程式
2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)
乙醇发生消去反应的方程式
CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)
两分子乙醇发生分子间脱水
2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)
乙醇和乙酸发生酯化反应的方程式
CH3COOH+C2H5OH→CH3COOC2H5+H2O
乙酸和镁
Mg+2CH3COOH→(CH3COO)2Mg+H2
乙酸和氧化钙
2CH3COOH+CaO→(CH3CH2)2Ca+H2O
乙酸和氢氧化钠
CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH
乙酸和碳酸钠
Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑
甲醛和新制的氢氧化铜
HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O
乙醛和新制的氢氧化铜
CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O
乙醛氧化为乙酸
2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)
烯烃是指含有C=C键的碳氢化合物。属于不饱和烃。烯烃分子通式为CnH2n,非极性分子,不溶或微溶于水。容易发生加成、聚合、氧化反应等。
乙烯的物理性质
通常情况下,无色稍有气味的气体,密度略小比空气,难溶于水,易溶于四氯化碳等有机溶剂。
1) 氧化反应:
①常温下极易被氧化剂氧化。如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去,由此可用鉴别乙烯。
②易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟。
2) 加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
3) 聚合反应:
2.乙烯的实验室制法
(1)反应原理:CH3CH2OH===CH2=CH2↑+H2O (条件为加热,浓H2SO4)
(2)发生装置:选用“液液加热制气体”的反应装置。
(3)收集方法:排水集气法。
(4)注意事项:
①反应液中乙醇与浓硫酸的体积比为1∶3。
②在圆底烧瓶中加少量碎瓷片,目的是防止反应混合物在受热时暴沸。
③温度计水银球应插在液面下,以准确测定反应液温度。加热时要使温度迅速提高到170℃,以减少乙醚生成的机会。
④在制取乙烯的反应中,浓硫酸不但是催化剂、吸水剂,也是氧化剂,在反应过程中易将乙醇氧化,最后生成CO2、CO、C等(因此试管中液体变黑),而硫酸本身被还原成SO2。SO2能使溴水或KMnO4溶液褪色。因此,在做乙烯的性质实验前,可以将气体通过NaOH溶液以洗涤除去SO2,得到较纯净的乙烯。
乙炔又称电石气。结构简式HC≡CH,是最简单的炔烃。化学式C2H2
分子结构:分子为直线形的非极性分子。
无色、无味、易燃的气体,微溶于水,易溶于乙醇、丙酮等有机溶剂。
化学性质很活泼,能起加成、氧化、聚合及金属取代等反应。
能使高锰酸钾溶液的紫色褪去。
乙炔的实验室制法:CaC2+2H2O→Ca(OH)2+C2H2↑
化学性质:
(1)氧化反应:
a.可燃性:2C2H2+5O2 → 4CO2+2H2O
现象:火焰明亮、带浓烟 。
b.被KMnO4氧化:能使紫色酸性高锰酸钾溶液褪色。
(2)加成反应:可以跟Br2、H2、HX等多种物质发生加成反应。
现象:溴水褪色或Br2的CCl4溶液褪色
与H2的加成
CH≡CH+H2 → CH2=CH2
与H2的加成
两步反应:C2H2+H2→C2H4
C2H2+2H2→C2H6 (条件为催化剂)
氯乙烯用于制聚氯乙烯
C2H2+HCl→C2H3Cl nCH2=CHCl→=-[-CH2-CHCl-]n- (条件为催化剂)
(3)由于乙炔与乙烯都是不饱和烃,所以化学性质基本相似。金属取代反应:将乙炔通入溶有金属钠的液氨里有氢气放出。乙炔与银氨溶液反应,产生白色乙炔银沉淀.
1、 卤化烃:官能团,卤原子
在碱的溶液中发生“水解反应”,生成醇
在碱的醇溶液中发生“消去反应”,得到不饱和烃
2、 醇:官能团,醇羟基
能与钠反应,产生氢气
能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去)
能与羧酸发生酯化反应
能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化)
3、 醛:官能团,醛基
能与银氨溶液发生银镜反应
能与新制的氢氧化铜溶液反应生成红色沉淀
能被氧化成羧酸
能被加氢还原成醇
4、 酚,官能团,酚羟基
具有酸性
能钠反应得到氢气
酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基
能与羧酸发生酯化
5、 羧酸,官能团,羧基
具有酸性(一般酸性强于碳酸)
能与钠反应得到氢气
不能被还原成醛(注意是“不能”)
能与醇发生酯化反应
6、 酯,官能团,酯基
能发生水解得到酸和醇
物质的制取:
实验室制甲烷
CH3COONa+NaOH→Na2CO3+CH4 (条件是CaO 加热)
实验室制乙烯
CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)
实验室制乙炔
CaC2+2H2O→Ca(OH)2+C2H2↑
工业制取乙醇:
C2H4+H20→CH3CH2OH (条件为催化剂)
乙醛的制取
乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)
乙烯氧化法:2 CH2=CH2+O2→2CH3CHO(条件为催化剂,加热)
乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热)
乙酸的制取
乙醛氧化为乙酸 :2CH3CHO+O2→2CH3COOH(条件为催化剂和加温)
加聚反应:
乙烯聚合
nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)
氯乙烯聚合
nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)
氧化反应:
甲烷燃烧
CH4+2O2→CO2+2H2O(条件为点燃)
乙烯燃烧
CH2=CH2+3O2→2CO2+2H2O(条件为点燃)
乙炔燃烧
C2H2+3O2→2CO2+H2O (条件为点燃)
苯燃烧
2C6H6+15O2→12CO2+6H2O (条件为点燃)
乙醇完全燃烧的方程式
C2H5OH+3O2→2CO2+3H2O (条件为点燃)
乙醇的催化氧化的方程式
2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)
乙醛的催化氧化:
CH3CHO+O2→2CH3COOH (条件为催化剂加热)
取代反应:有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
甲烷和氯气发生取代反应
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
(条件都为光照。)
苯和浓硫酸浓硝酸
C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)
苯与苯的同系物与卤素单质、浓硝酸等的取代。如:
酚与浓溴水的取代。如:
烷烃与卤素单质在光照下的取代。如:
酯化反应。酸和醇在浓硫酸作用下生成酯和水的反应,其实质是羧基与羟基生成酯基和水的反应。如:
水解反应。水分子中的-OH或-H取代有机化合物中的原子或原子团的反应叫水解反应。
①卤代烃水解生成醇。如:
②酯水解生成羧酸(羧酸盐)和醇。如:
乙酸乙酯的水解:
CH3COOC2H5+H2O→CH3COOH+C2H5OH(条件为无机酸式碱)
加成反应。
不饱和的碳原子跟其他原子或原子团结合生成别的有机物的反应。
乙烯和溴水
CH2=CH2+Br2→CH2Br-CH2Br
乙烯和水
CH2=CH2+H20→CH3CH2OH (条件为催化剂)
乙烯和氯化氢
CH2=H2+HCl→CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2→CH3-CH3 (条件为催化剂)
乙炔和溴水
C2H2+2Br2→C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2→C2H4---------C2H2+2H2→C2H6 (条件为催化剂)
苯和氢气
C6H6+3H2→C6H12 (条件为催化剂)
消去反应。有机分子中脱去一个小分子(水、卤化氢等),而生成不饱和(含碳碳双键或碳碳三键)化合物的反应。
乙醇发生消去反应的方程式
CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)
两分子乙醇发生分子间脱水
2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)
不是很完全,但是基本可以了。
高中化学必修二有机部分加成反应聚合反应取代反应酯化反应等反应类型对比及比较求详解?大神留步!
由A与NaHCO3溶液反应可以确定A中有—COOH;
由A与[Ag(NH3)2]+、OH-反应可知A中含有—CHO;
综合E到F的反应条件、E中含—COOH、F的分子式及是一个环状化合物,可以推测F是一个环酯,E分子中的—OH来自于—CHO与H2的加成,而1 mol A 与2 mol H2反应生成 1 mol E,所以A中还含有一个碳碳双键。
A经E到F的过程中只有成环而无碳原子的增减,所以A中也只含有4个碳原子;
A经B到D的反应过程中没有碳链的改变,所以A分子的碳链结构中也没有支链;结合A中的官能团可以确定A的结构简式为:OHC—CH CH—COOH。
1 mol A 与2 mol H2发生加成反应,分别是碳碳双键、醛基的加成。
与A具有相同官能团的A 的同分异构体应该有一个支链。
B在酸性条件下,由盐生成了酸,结构中的碳碳双键再与Br2发生了加成反应。
答案:
(1)碳碳双键,醛基,羧基
(2)OHC—CH=CH—COOH + 2H2 ---(加热)Ni----HO—CH2—CH2—CH2—COOH
(3)CH2=C-COOH
|
CHO
(醛基连在中间的碳原子上)
(4)HOOC-CH-CH-COOH
| |
Br Br
(两个溴连在中间两个碳原子上)
(5) O
/ \
CH2 C=O
\ /
CH2-CH2
(一个五元环,头顶的是氧原子,旁边连一个羰基,剩下三个都是-CH2)
酯化反应
(不知道看得懂不懂,这不好画,给您理解上带来不便,请谅解)
第五章《进入有机合成高分子时代》习题课 (1课时)
合成有机高分子的四种基本聚合反应类型方程式书写
一、学习目标
1 认识化学对创造更多物质财富和精神财富、满足人民日益增长的美好生活需要的重大贡献,形成节约资源、保护环境的可持续发展意识。体会学习化学科学的重大意义,形成积极的社会责任感。
2 通过练习深刻理解加聚反应和缩聚反应的反应原理和书写规律
3 能够熟练地写出四种常见聚合反应的方程式
二、学法指导
1、从生活物质到化学,从化学到生活物质,体会生活与化学的关系。
2、运用加聚反应原理、1、3-丁二烯的1,4加成反应原理、酯化反应原理、苯酚和甲醛的性质等知识理解反应的书写。
三、知识链接
1、巴斯夫公司:我们创造化学新作用、我们创造幸福生活。我们通过科学和创新追求经济上的成功、社会责任和环境保护相结合。
2、帮宝适纸尿裤的“神奇吸水珠珠”是功能高分子,主要材料是有机合成聚丙酸钠树脂。
3、橡胶:分为天然橡胶和合成橡胶。天然橡胶是顺式聚异戊二烯,还有杜仲胶,是反式聚异戊二烯。常见的合成橡胶是丁苯橡胶。橡胶硫化后硬度变强。经过工艺处理后的橡胶拥有更多优良性能。
4、有机合成高分子:有机合成材料主要是指通过化学合成将小分子有机物如烯烃等合成大分子聚合物。
棉花、羊毛和天然橡胶等都属于天然有机高分子材料。天然有机高分子材料并不能满足人们的生活需要。人们用石油化工产品进行有机合成得到合成有机高分子材料。有机合成材料在生活中用的最多的是塑料。有机合成材料在日常生活,农业、工业生产中具有重要作用。
5、功能性高分子:是指具有某些特定功能的高分子材料。它们之所以具有特定的功能,是由于在其大分子链中结合了特定的功能基团,或大分子与具有特定功能的其他材料进行了复合,或者二者兼而有之。例如吸水树脂,它是由水溶性高分子通过适度交联而制得,遇水时将水封闭在高分子的网络内,吸水后呈透明凝胶,因而产生吸水和保水功能。如聚丙烯酸钠、聚乙炔等。
在合成或天然高分子原有力学性能的基础上,再赋予传统使用性能以外的各种特定功能(如化学活性、光敏性、导电性、催化活性、生物相容性、药理性能、选择分类性能等)而制得的一类高分子。一般在功能高分子的主链或侧链上具有显示某种功能的基团,其功能性的显示往往十分复杂,不仅决定于高分子链的化学结构、结构单元的序列分布、分子量及其分布、支化、立体结构等一级结构,还决定于高分子链的构象、高分子链在聚集时的高级结构等,后者对生物活性功能的显示更为重要。
四、学习流程
(一)独学
任务1、阅读课本选修5第五章第一节,完成课后习题。
任务2、阅读以上“知识链接”,上网查阅了解高分子材料.
高分子的命名为“聚+单体”
(二)群学
任务1:观看视频,体会化学对社会发展的作用,写下自己的感受。
我的感悟
任务2:观看视频,认识功能高分子:帮宝适的神奇珠珠——聚丙烯酸钠树脂的吸水性。
(1)指出聚丙烯酸钠的单体,并写出合成反应方程式,指出反应类型
(2)已知聚乙炔和聚丙烯酸钠一样是功能性高分子,有导电性。请写出其合成方程式,指出反应类型。
★★3、已知两种同样含有碳碳双键的分子也可以通过加聚反应聚合为高分子,试写出丙烯和苯乙烯发生加聚反应的方程式。然后课后群学。
任务3:观看材料,认识橡胶,完成练习,讨论正误,形成认识。
(1)天然橡胶是巴西三叶橡胶树产出的橡胶。是异戊二烯(即2-甲基-1,3-丁二烯)的聚合物,具有顺式结构,成为顺式聚异戊二烯。写出其单体,聚合方程式,指出反应类型。
(2)氯丁橡胶具有耐燃、耐油等优良性能,它的单体是2-氯-1,3-丁二烯,请写出氯丁橡胶的合成方程式。
任务4:观看材料,认识聚酯纤维,完成以下练习,讨论正误,形成认识。
(1)合成纤维中目前占第一位的是聚酯纤维——涤纶,涤纶是聚对苯二甲酸乙二醇酯纤维的商品名。写出其聚合方程式,指出反应类型。
(2)写出聚己二酸丙二醇酯纤维的聚合方程式.
任务5:观看材料,认识酚醛树脂,完成以下练习,讨论正误,形成认识。
(1)已知甲醛和苯酚在酸性条件下发生加成反应生成羟甲基苯酚,羟甲基苯酚之间再相互脱水缩合成线型结构高分子。这种高分子构成了酚醛树脂的基础。写出这两个反应,指出其反应类型。
(2)写出氨基酸H2N-CH2-COOH缩合为多肽的反应方程式。
(三)展示 (与群学同步)
(四)总结: 四种基本聚合反应类型的方程式书写方法。(在知识清单上填空)
五、当堂检测
见:人教版课本第五章总复习练习1、2
六、知识清单
四种基本聚合反应方程式的书写
1加聚反应——无端基原子、无小分子生成。
(1) 双键或者三键加聚:
断一键,两侧碳原子再成新键,中括号括在
(2)有1、3丁二烯型间隔双键的分子加聚:
两个双键各断一键,中括号括在 ,2、3号碳之间成一键变成 。2缩聚反应——有端基原子、有小分子生成
(1)二种单体的缩聚:参考二酸和二醇的缩合。若 n 个分子参加反应,则生成 个小分子。
(2)一种单体缩聚:参考氨基酸缩聚。若 n 个分子参加反应生成 个小分子。
端基原子根据具体物质、具体反应定。
七、日清反思
写聚合反应方程式,你的困难是
如何克服困难?









